|
|
视野为中心暗点的视神经病变病因分析视野为中心暗点的视神经病变病因分析来源---眼科学术平台
1、对象与方法
1.1 对象 本研究为回顾性分析。选择2018年8月至2020年3月在中山大学中山眼科中心神经眼科专科门诊就诊,视野表现为中心暗点,且随访一年以上的视神经病变患者。
1.2 纳入及排除标准 纳入标准:1)单眼或双眼视力下降;2)视野为中心暗点;3)OCT 检查示黄斑区视网膜结构无明显异常,多焦视网膜电位图(multifocal electroretinogram,多焦 ERG) 结果正常。 排除标准:1)青光眼病史;2)严重影响视力的屈光间质浑浊;3)合并葡萄膜炎、高度近视或其他视网膜疾病。
1.3 方法 所有患者均具备详细的病史采集,包括性别、年龄、饮食习惯、工作环境、烟酒嗜好、既往眼病史、全身病史和家族史等。 所有纳入的患者均有双眼眼科检查记录,包括:Snellen视力表查最佳矫正视力(best-corrected visual acuity,BCVA)、喷气式非接触眼压计测量眼压、裂隙灯显微镜检查眼前节、前置镜检查眼底、SD-OCT检查黄斑及视盘周围神经纤维层厚度(peripapillary retinal nerve fiber layer,RNFL)、30 °视野、颅脑及眼眶核磁共振 (magnetic resonance imaging,MRI)检查。所有患者均具备相关血液检测结果,包括血常规、血生化、肝肾功能、感染指标(乙肝、丙肝、梅毒、HIV及结核T-spot)检查及Leber遗传性视神经病变的线粒体DNA(mitochondrial DNA,mtDNA)和OPA1基因检测。患者的临床随访时间均为1年以上。 乙胺丁醇中毒性视神经病变 (ethambutol-induced optic neuropathy,EON)的诊断标准参照文献[3],确定为:视力下降发生于乙胺丁醇治疗后或停药2个月内,且至少满足2个次要标准,即:①色觉异常;②中心、旁中心暗点或颞侧偏盲;③视盘充血或苍白。 特发性脱髓鞘性视神经炎(idiopathic demyelinating optic neuritis,IDON)的诊断标准参照中国脱髓鞘性视神经炎诊断和治疗循证指南(2021年)[4-5],确定为:急性视力下降;排除缺血、外伤、压迫及浸润、中毒、营养和遗传性视神经病变等;至少合并以下2项异常:①相对性瞳孔传入障碍;②视野损害;③视觉诱发电位异常;④色觉障碍;同时,水通道蛋白4(aquaporin 4,AQP4)及髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体阴性。
2、结果
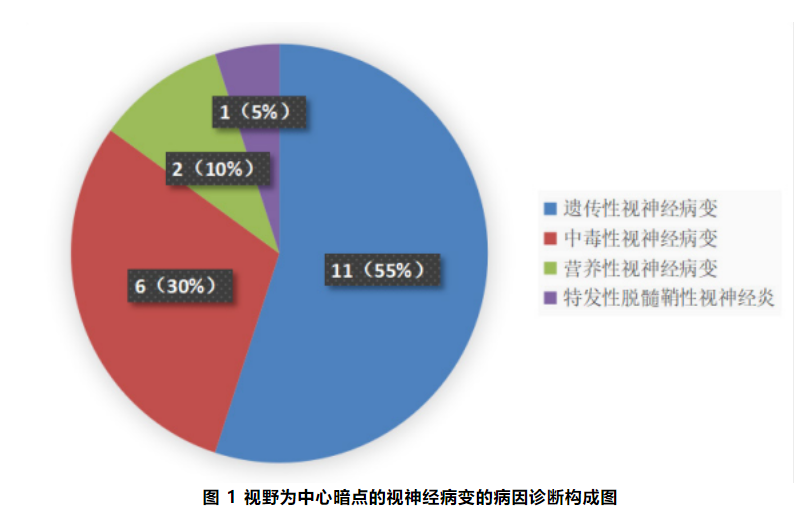
2.1 患者的一般资料 共20例患者纳入研究。诊断为遗传性视神经病变的患者数最多(图1),共11例 (男性9例,女性2例 ),其中Leber遗传性视神经病变 (Leber here-ditary optic neuropathy,LHON)9例,显性视神经萎缩(dominant optic atrophy,DOA)2例。6例被确诊为EON,男性4例及女性2例,合并mtDNA和OPA1基因突变各1例。营养性视神经病变 (nu-tritional optic neuropathy,NON)2例,男女各1例,其中女性患者为Wernicke脑病。特发性脱髓鞘性视神经炎1例,为女性。患者的一般资料见表1。
Figure 1 Diagnostic composition of the etiology of optic neuropathy with central scotoma in the visual field
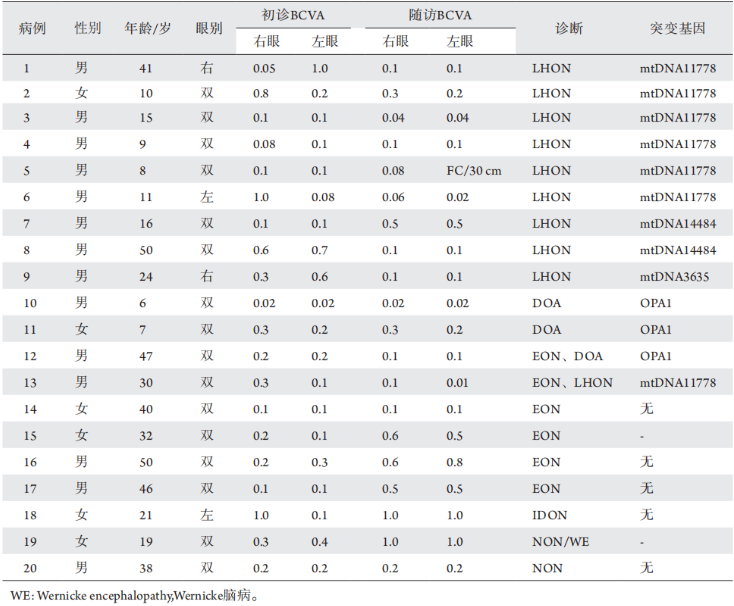
表1 患者的一般资料 Table 1 General information about the patients
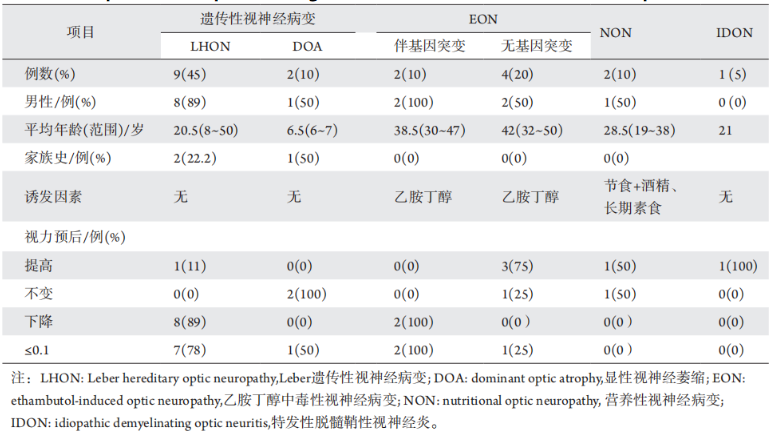
将患者按照病因分组,统计基本临床资料及视力预后(表2)。患者性别比例方面,LHON组男性比例明显增高,为 89%。平均发病年龄方面,EON组年龄最大,为41岁;而 DOA 组年龄最小,为10岁以下。视力预后方面,EON合并基因突变和LHON患者视力预后较差,随访BCVA≤0.1的比例分别为 100% 和 78%;而EON无基因突变者视力改善良好,75%的患者随访视力提高。
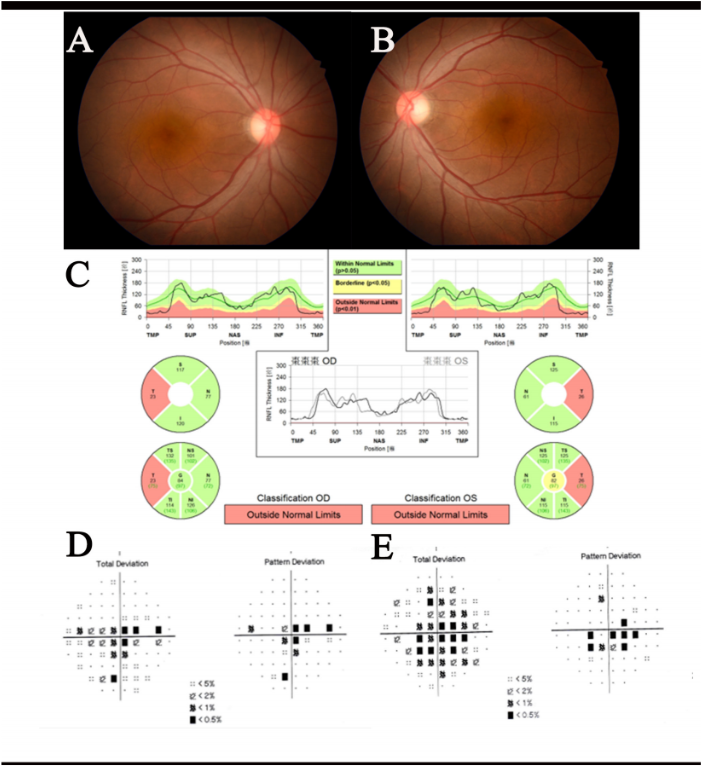
2.2 按病因分类的临床资料分析 LHON患者平均年龄20.5岁,最小为8岁,最大为50岁。LHON患者中年龄最大者8号病例,突变基因为罕见的 m.14484T>C;1号病例年龄也较大,为41岁,携带 m.11778G>A,右眼发病10个月后对侧眼发病。基因检测显示,6例为ND4m.11778G>A 突变,2例ND6m.14484T>C,1例ND1m.3635G>A位点突变。2例 (22.2%) 问诊时承认有家族史,分别为病例3(其舅舅及表兄弟有相似病史)和病例5(其双胞胎哥哥1年前被确诊)。男女比例为8∶1。 DOA患者平均年龄6.5岁。其中10号病例为6岁男童,入学体检时发现双眼视力差,就诊时已表现出双眼视神经萎缩,有明确家族史,OPA1基因突变;患儿母亲存在相同位点突变,双眼BCVA0.5,既往自觉视力正常,未曾诊治。11号病例为7岁女童,其父亲存在相同基因位点突变,但视力和眼底检查均未见异常。 EON患者发病年龄相对较大,伴mtDNA或OPA1基因突变者平均年龄38.5岁,无基因突变者平均年龄42岁。伴有基因突变者预后差,随访BCVA≤0.1(100%),无基因突变者停药后 75% 视力改善,随访BCVA≤0.1者仅1例 (25%)。IDON患者为21岁女性,以左眼突然视力下降伴中心暗点就诊,明确诊断后给予糖皮质激素(激素)冲击治疗,继以口服激素逐渐减量治疗1个月后,BCVA恢复至1.0,随访时间1年,无复发,视力稳定。 营养性视神经病变患者2例。19号病例为19岁女性,3个月以来节食减肥,食物摄入量控制在150g/d,每天饮蒸馏白酒约300~500mL,就诊时双眼视力下降伴中心暗点,伴头晕、步态不稳;颅脑MRI提示中脑导水管周围灰质高信号;内科会诊诊断为Wernicke脑病,予维生素B1静脉注射治疗后双眼视力迅速恢复正常,视野恢复正常,中心暗点消失;嘱其恢复正常饮食,随访18个月,视力、视野均正常。20号病例(图2)有吸烟嗜好及监狱服刑史,服刑期间患者拒绝任何肉食,维持无动物蛋白饮食9个月后双眼视力下降,未提出诊治要求,继续维持无动物蛋白饮食半年后结束服刑,恢复正常饮食,眼部未曾诊治。发病3年后就诊于我院门诊,血清学检查示血维生素B12、B1及叶酸在正常值范围。排除遗传性和中毒性病变后,随访1年患者视力及视野稳定无变化,考虑其中心暗点出现与既往严格素食明显相关,推测诊断为营养性视神经病变。
图 2 营养性视神经病变患者的眼底彩照、OCT 视盘周围RNFL分析图和Humphrey视野图
Figure 2 Fundus colour photographs, OCT peri-optic disc RNFL analysis and Humphrey visual field map of a patient with nutritional optic neuropathy (A、B) 为双眼眼底彩照,显示双眼对称性视盘颞侧苍白;(C) 显示双眼对称性视盘颞侧 RNFL 层明显变薄;(D、E) 分别为右眼和左眼的视野图,显示双眼对称性中心暗点。 Fig (A and B) are fundus colour photographs, showing symmetrical temporal pallor of the optic disc in both eyes; (C)shows symmetrical temporal thinning of the RNFL layer in both eyes; (D and E) are visual field maps of the right and left eyes respectively, showing symmetrical central scotoma in both eyes.
3、讨论 视野损害表现为中心暗点的视神经病变中,遗传性视神经病变是最常见的病因,其中以线粒体DNA突变引起的LHON和核DNA突变导致的DOA最常见。两种突变均可导致线粒体功能受损,表现为视网膜神经节细胞 (retinal ganglion cells,RGCs) 的选择性损害 [6],PMB最先受累,影响视觉信息从视网膜到大脑的传输。LHON为母系遗传病, 因mtDNA突变影响线粒体呼吸链复合体所致。LHON最常见的三个突变位点为ND1m.3460G>A、ND4m.11778G>A 和 ND6m.14484T>C,占所有突变类型的95%以上 [7]。本研究中,m.11778G>A 突变最常见, 有1例m.14484T>C,无m.3460G>A,与文献报道的中国LHON患者突变谱一致[8]。LHON除上述三个常见位点外,也有其他罕见原发突变,如 MT ND1基因的 m.3635G>A[9-10]。本研究中的9号患者在排除三个常见突变位点后,曾一度陷入诊断困难,扩大线粒体基因检测范围后锁定 m.3635G>A,且患者的母亲及姐姐也存在同样突变,但均无临床症状。因此,对于临床高度怀疑的患者,即使基因检测常见三个突变位点正常,也不能轻易排除LHON诊断,而应扩大线粒体基因检测范围。LHON具有不完全外显率和性别偏倚两大特征。男女携带者的发病率分别为50%和10%[11], 男性占总发病数的75%[7],推测与雌性激素可在一定范围内代偿性维持和促进线粒体的生物活动有关[12]。本研究中,男女比例为8∶1,且患者大多无明确家族史,体现了 LHON不完全外显的特点。LHON的发病年龄可累及2-87岁,其高峰年龄为15-35岁[7]。本研究中,年龄最大的患者为5岁男性,其次为41岁男性。因此在临床上,要注意老年男性仍有LHON发病的可能。鉴于LHON从儿童到老年的年龄跨度,有学者建议所有累及双眼的视神经病变均应与LHON进行鉴别诊断,特别是男性患者[7]。LHON可导致严重的视力损害,大多达到法定盲,预后较差。 DOA也是常见的遗传性视神经病变,但其临床表现与LHON有所不同。DOA系OPA1基因突变引起线粒体内膜蛋白GTPase 编码异常所致,为常染色体显性遗传,家族史相对明确[11]。大多儿童时期(10岁内) 发病,表现为缓慢进行性视力下降,常在体检时被发现,或20-30岁视力下降明显时就诊[13]。视力预后从光感到1.0不等,但通常好于LHON,约40%视力优于0.3[14-15]。疾病的严重程度和进展速度差别较大,即使在同一家系中,表现也可不同。本研究中男性患儿双眼BCVA<0.1,其母亲相同位点突变,双眼 BCVA0.5且自觉视力正常从未诊治,母子两人视力差距明显;女性患儿的父亲虽然存在OPA1基因突变,但视力正常。值得注意的是,LHON和DOA因为控制瞳孔对光反射的视网膜中脑顶盖神经纤维相对不受累[16] ,临床上可能表现为视力损害严重却瞳孔反射相对良好的情况。 乙胺丁醇为抗结核药物,对RGCs有直接毒性损伤,其具体机制尚不清楚,推测为线粒体的代谢紊乱 [17]。EON在服用乙胺丁醇人群中的发生率不足2%,与每日服用剂量和肾功能密切相关[18],儿童的发病率明显低于成人[19]。部分EON患者停药后视力改善,改善程度与年龄、就诊时视盘的颜色及是否合并线粒体相关基因突变密切相关[3, 20-21]。值得注意的是,临床诊断为EON的患者中,线粒体基因突变率高,特别是OPA1基因,在EON患者中可占38.3%,LHON-mtDNA突变占8.5%[3]。这种现象可能是线粒体基因突变导致视神经对毒性物质更敏感的结果,即视神经受到来自基因突变和环境毒性两方面的致病攻击。因此,即使EON诊断明确,也强烈建议排除是否同时存在遗传因素,特别是OPA1和LHON-mtDNA突变。基因突变患者的视力预后较差。本研究中的2例EON合并基因突变患者的随访 BCVA≤0.1。 营养性视神经病变非常罕见,但随着减肥手术的开展,发病开始增多。其病理机制为RGCs线粒体氧化磷酸化受损。营养性、遗传性和中毒性视神经病变可统称为线粒体性视神经病变(mitochondrial optic neuropathy)[22],其中遗传性视神经病变为先天性,中毒性和营养性视神经病变为获得性。与烟酒相关的视神经病变,既往临床上多归于中毒性视神经病变,现归属于营养性视神经病变。最早文献中提及的烟酒性弱视 (tobacco-alcohol amblyopia),因命名为“弱视”,不能反映视神经病变本质,目前该名称已被弃用。学术界一致认为,没有证据表明烟草和酒精(乙醇)可直接导致中毒性视神经病变,烟酒中毒性视神经病变(tobacco-alcohol optic neuropath) 名称亦不合适[23]。酒精(乙醇)中毒性视神经病变的本质为饮酒嗜好引起胃黏膜损伤、肠道刺激、厌食症或肝功能损害从而导致饮食营养缺乏[24] ,例如长期饮酒可导致维生素B1缺乏。烟草中的氰化物的确对视神经有毒性作用,但维生素B12对氰化物有解毒作用,维生素B12缺乏可降低氰化物对视神经损害的阈值;因此即便在保持烟酒摄入的情况下,如果补充B族维生素,既往诊断为烟酒中毒性视神经病变的患者视力可部分或完全恢复,因此,应命名为营养性视神经病变[25]。部分“烟酒中毒性视神经病变”的患者最终诊断为LHON,一定程度上说明了烟酒中毒性视神经病变的诊断值得怀疑,可能是烟酒刺激诱发了LHON[26]。营养不良导致视神经病变最典型的例子就是古巴的流行性视神经病变[27],发生于食物匮乏时期,最常缺乏的营养元素为维生素B12、维生素B1和铜。文献报道[28],自闭症患儿严重挑食、几乎完全缺乏动物蛋白摄入时,可出现双眼视力下降中心暗点,血清检查维生素B12水平明显下降,补充维生素B12后双眼视力改善。营养性视神经病变目前多发生于胃肠减肥手术后。减肥手术如可调节胃束带术、袖状胃切除术、胆胰分流术等,都是通过胃肠手术限制食物摄入量、制造吸收不良或消化不良,从而达到减少热量摄取的目的。对于营养性视神经病变,临床上需要详细询问病史鉴别营养缺乏的原因,并排除毒性物质接触及遗传因素,辅以血维生素B12、B1、叶酸、铜、锌等实验室检查帮助确诊。 上述的遗传性、中毒性和营养性视神经病变的病理机制都与线粒体的功能障碍密切相关。线粒体的结构和功能损害可发生于身体的所有有核细胞,但临床上却往往仅表现在特定的组织或细胞,如视神经和RGCs中,这可能是视觉系统的特殊解剖和功能所致。为达到最佳的视觉水平,视网膜的RGCs无髓鞘包裹,在保障良好的信息传导时,RGCs的能量消耗非常巨大;RGCs一旦进入筛板后,其所有轴突都髓鞘化,其高效的跳跃传导模式大大减少对能量的需求[29]。线粒体在RGCs的分布与髓鞘化程度负相关,筛板前的无髓鞘部分线粒体分布异常密集,这种特殊解剖结构可以解释为什么线粒体疾病常表现为眼部视力异常[30]。 视野中心暗点的视神经病变,除了上述的线粒体性视神经病变,也可以是脱髓鞘性视神经炎的早期表现。视神经炎的脱髓鞘病变并不特殊青睐于任何一束神经纤维,因此PMB的神经纤维束同样有受累可能。视神经炎的视野可表现为任何类型[31],包括中心暗点;视神经脊髓炎和多发性硬化相关性视神经炎都可以表现为中心暗点,其中后者的中心暗点视野更为常见,而前者因AQP4的血管损害,上下半侧视野损害更常见[32];甚至视神经周围炎也可以表现为中心暗点[33]。本研究中,1例以视野中心暗点、视力下降就诊,排除遗传性视神经病变,临床表现及颅脑眼眶MRI符合视神经炎表现,诊断为特发性脱髓鞘性视神经炎,治疗后视力恢复正常。 综上所述,视野中心暗点提示视神经疾病中的PMB受累,可能与线粒体性视神经疾病、脱髓鞘性视神经炎相关。LHON和DOA都具有不完全外显性,LHON因其母系遗传及外显率低,家族史往往不明显;DOA 早期视力下降不明显的亚临床表现和OPA1低外显率,也可导致家族史不明确[29]。临床中对于视野中心暗点视神经病变,需详细询问家族史、服药史及营养饮食状况,行LHON-mtDNA 和OPA1基因检测予以诊断或鉴别诊断。本研究存在样本量过小、选择偏倚等局限,但是也在一定程度上反映了视野以中心暗点为特点的视神经病变的疾病谱,为临床医生对此类患者的进一步诊治提供参考。更权威的结果有待于多中心、大样本的临床研究进一步验证。
引用本文:练苹, 宋慧莹, 周孝来, 赵秀娟, 吕林. 视野为中心暗点的视神经病变病因分析[ J]. 眼科学报, 2023, 38(3): 181-189. doi:10.12419/j.issn. 1000-4432.2023.03.02 Cite this article as:LIAN Ping, SONG Huiying, ZHOU Xiaolai, ZHAO Xiujuan, LV Lin. Analysis of the etiology of the optic neuropathies with visual field defect of central scotoma[ J]. Eye Science, 2023, 38(3): 181-189. doi:10.12419/j.issn.1000-4432.2023.03.02
【下一篇】 眼化学性烧伤 |